- Qu'est-ce qu'un atome ?
- Comment se compose un atome ?
- Comment les atomes se combinent-ils ?
- Parties d'un atome
- Histoire de l'atome
- Molécule
Nous expliquons ce qu'est un atome et comment chacune de ses parties est constituée. Aussi, son histoire, des études à son sujet et ce qu'est une molécule.

Qu'est-ce qu'un atome ?
La plus petite unité qui constitue le la matière.
Le mot atome vient du grec ancien (atome, "Sans division") et a été inventé par les premiers philosophes à théoriser sur la composition des choses, c'est-à-dire les particules élémentaires de la univers. Depuis, avec l'émergence de la modèles atomiques, la façon de les imaginer a énormément varié, car un modèle atomique a succédé au précédent à travers les siècles, jusqu'à atteindre celui que nous utilisons aujourd'hui.
Les atomes ont les propriétés de élément chimique qui composent et, à leur tour, les éléments sont organisés et classés selon leur numéros atomiques, configuration électronique et propriétés chimiques dans Table périodique des éléments.
Un même élément chimique peut être composé de différents atomes de la même classe, c'est-à-dire de même numéro atomique (nombre de protons que chaque atome a dans l'élément), bien que leurs masses atomiques soient différentes.
Par exemple, il existe différents atomes du même élément qui diffèrent par leur nombre de neutrons, et ils sont appelés isotopes, un cas représentatif est celui des isotopes de l'élément carbone (12C, 13C, 14C). Ainsi, chaque atome appartient ou non au même élément chimique, selon son nombre de protons, donc les atomes ayant le même nombre de protons appartiennent au même élément chimique.
Comment se compose un atome ?
Les atomes sont constitués d'un noyau et d'un ou plusieurs électrons (qui ont une charge négative) autour de lui. Le noyau est composé de particules appelées protons et neutrons. Les protons sont chargés positivement et les neutrons sont neutres. L'ensemble des protons et des neutrons est appelé nucléons.
Les protons et les électrons sont attirés les uns vers les autres par la force électromagnétique (l'interaction des particules chargées avec les champs électriques et magnétiques), tandis que les protons et les neutrons sont attirés les uns vers les autres par la force nucléaire (une force subie uniquement par les particules qui composent le noyau atomique).
Comment les atomes se combinent-ils ?
Les atomes peuvent se combiner pour former liens chimiques, que se passe-t-il lorsqu'ils partagent leurs électrons d'une manière ou d'une autre. Les liaisons chimiques peuvent être covalent, ionique Oui métallique, qui est à l'origine de composés moléculaires covalents, de réseaux ioniques ou de composés métalliques (bien qu'il soit important de préciser qu'aucune liaison chimique n'est absolument covalente ou ionique). De cette façon, les atomes peuvent se combiner pour former molécules simple comme le L'eau, ainsi que pour former macromolécules complexe comme protéine, ADN Oui ARN.
Si les atomes se distinguent les uns des autres grâce à la configuration de leurs particules, il est également vrai que tous les atomes d'un même élément sont exactement identiques : les atomes d'hydrogène dans le soleil Ce sont les mêmes que ceux qui composent notre corps, et les atomes de carbone dans le corps d'un chien sont identiques à ceux qui composent un diamant. La différence réside dans la manière dont les atomes se combinent pour constituer les différents composés chimiques qui constituent les organes et les systèmes d'organes dans le êtres vivants, les matériaux générés dans le industrie, et toute la matière qui compose l'univers.
Parties d'un atome
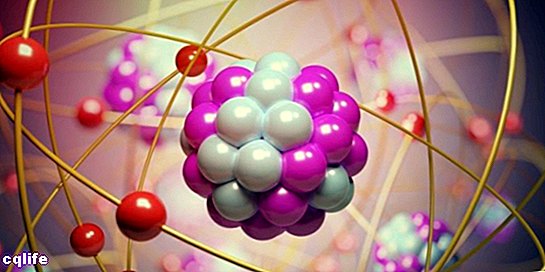
Les atomes sont constitués de deux parties essentielles :
- Le noyau. Environ 99,94 % de la masse d'un atome est concentrée dans le noyau, où les protons et les neutrons (qui sont appelés ensemble "nucléons") sont réunis par de fortes forces nucléaires, ce qui empêche les protons qu'ils se repoussent, d'avoir le même charger.
- Les orbitales atomiques. Une orbitale décrit une région de l'espace entourant le noyau atomique dans laquelle le probabilité pour trouver un électron est très élevé. Ces régions ont des formes différentes qui sont obtenues à la suite de la résolution de l'équation de Schrödinger stationnaire. Erwin Schrödinger était un scientifique autrichien qui a développé cette équation en 1925 pour calculer l'évolution d'une particule subatomique, comme les électrons. Ainsi, les électrons forment une sorte de "nuage" autour du noyau, qui est représenté par la forme des orbitales atomiques. D'autre part, chaque orbitale atomique correspond à une certaine valeur énergétique pour les électrons, ils sont donc organisés en fonction de leurs valeurs énergétiques. La figure suivante montre les formes des premières orbitales atomiques :

Histoire de l'atome

Le premier à formuler l'idée de l'existence des atomes fut le philosophe grec Démocrite (art.V-VI BC) à partir de spéculations purement imaginaires (au sens où l'on entendait la science à cette époque).
Ses études ont été reprises par des philosophes ultérieurs tels que Leucippe et Épicure, mais elles ont été négligées au cours de la médiéval, éclipsé par l'explication créationniste du monde, qui attribuait tout à Dieu.
Il faudra attendre 1773 pour que le chimiste français Antoine de Lavoisier postule sa théorie sur la non-création ou la destruction de la matière (elle ne fait que transformer) ou Loi de conservation de masse, qui a permis à John Dalton de formuler la première théorie atomique moderne en 1804.
Les savants successifs de la physique et la chimie ils se sont inspirés de ses travaux pour proposer des systèmes meilleurs et plus complexes pour comprendre les particules fondamentales de la matière. Par la suite, de nouveaux modèles atomiques ont été proposés jusqu'aux plus utilisés aujourd'hui.
La structure contemporaine acceptée est celle dérivée de la expériences de Rutherford en 1911, ainsi que les formulations de Niels Bohr, Schrödinger et Heisenberg.
Molécule
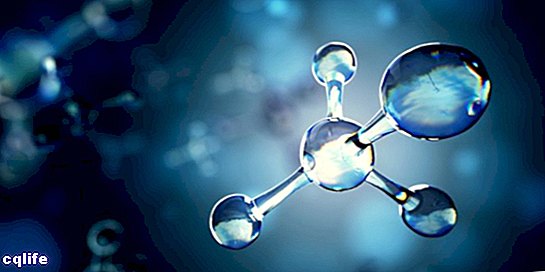
Une molécule est connue comme l'union de deux atomes ou plus par des liaisons chimiques pour former une structure plus complexe et électriquement neutre. Les liaisons chimiques peuvent être covalentes ou ioniques.
Les molécules peuvent être constituées d'atomes d'un même élément chimique, par exemple la molécule d'oxygène (O2), ou d'atomes d'éléments chimiques différents, par exemple la molécule de glucose. Les gaz monoatomiques, par exemple l'hélium (He), sont également considérés comme des molécules.

